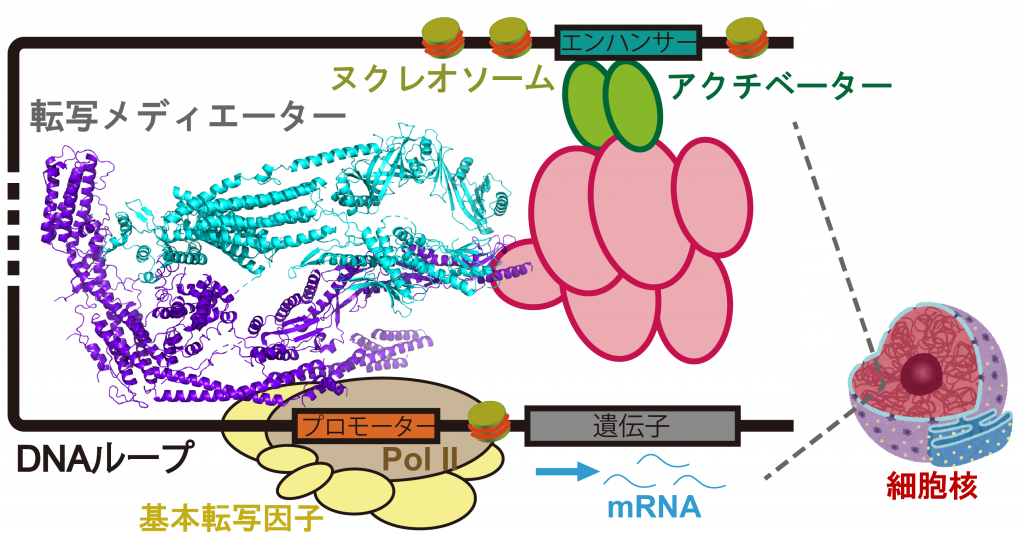
ヒトは約2万種類のタンパク質遺伝子から構成されていますが、細胞の分化や発生状態に応じたタンパク質発現をコントロールするために、エンハンサーDNAの数は数十万にものぼります。興味深いことにエンハンサーDNAからのタンパク質遺伝子の活性化シグナルは、数キロから 数十Mbpもの長鎖DNAを経て標的遺伝子のプロモーターDNAへと伝わり、この情報伝達は2つのDNA領域が物理的に近接して「DNAループ」構造を作ることによって行われています。転写メディエーターは、真核生物特有の転写コファクターであり、この膨大なエンハンサーDNAとプロモーターDNAを対合させ、転写開始点にRNAポリメラーゼIIをリクルートすることで、ほぼすべてのタンパク質発現をコントロールしています。最近では、ガン原遺伝子の上流で多数のDNAループがクラスターを作り、遺伝子の異常な活性化を招くスーパーエンハンサー構造も注目を集めています。スーパーエンハンサー中では、DNAループ同士がクロストークを行うだけでなく、転写メディエーターやRNAポリメラーゼIIに存在する天然変性領域が会合して液-液相分離が起こり、非膜構造の中に転写反応を促進するためのリアクターが形成されることも知られています。
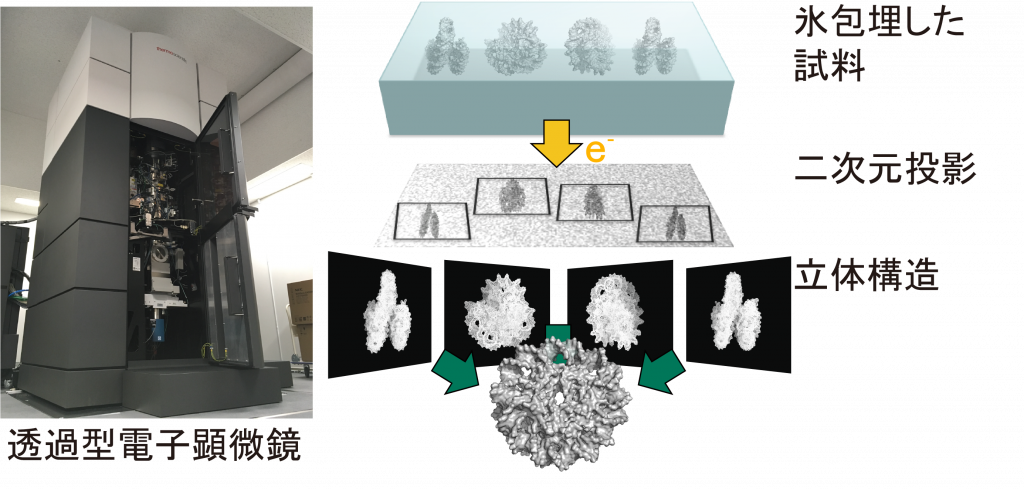
私たちの研究室では、X線結晶構造解析法や2017年にノーベル化学賞を受賞したクライオ電子顕微鏡解析法などの「原子の世界を覗く技術」を用いてゲノム構造とリンクした遺伝子発現制御機構や疾患のメカニズムを解明したいと考えています。特にクライオ電子顕微鏡解析は、氷包埋した分子の複数の溶液構造を一挙に構造解析することも可能であり、得られたスナップショット構造群をつなぎ合わせることで、分子のダイナミクスや酵素反応を一連のムービーのように理解することも可能です。最近では、クライオ電子線トモグラフィー法の発展も目覚ましく、凍結細胞のスライスから、原子分解能で構造を決定することも可能になってきました。私たちのグループでは、これまでに酵母の生育に必須の転写メディエーター・15サブユニットのX線結晶構造解析にも成功しています。また、クライオ電子顕微鏡解析を通じて新しいクロマチン構造基盤ユニットであるH3-H4オクタソームを独自に発見しました。私たちの研究室では、こうしたゲノムの折り畳み構造を細胞内環境を反映した形で解析するために、電子顕微鏡観察グリット上で、内因性の複合体を精製する技術や核内環境を模倣した状態でゲノム構造を観察する技術など、クライオ電子顕微鏡解析の新たな技術プラットフォームの開発にも取り組んでいます。